Các nhà khoa học đã đạt được bước tiến đột phá trong việc ứng dụng AI để tạo ra hai loại protein kháng nọc rắn hoàn toàn mới. Những protein này, được gọi là "de novo" - những phân tử chưa từng tồn tại trong tự nhiên, có khả năng vô hiệu hóa các độc tố nguy hiểm trong nọc rắn. Kết quả nghiên cứu, công bố trên tạp chí Nature ngày 15/1, cho thấy khi kết hợp hai loại protein mới với độc tố rắn và tiêm cho chuột thí nghiệm, 100% số chuột đã được cứu sống.
Susana Vázquez Torres - nhà hóa sinh và đồng thời là người nghiên cứu chính của công trình tạo ra protein kháng độc rắn bằng AI, chia sẻ “Tôi nghĩ chúng ta có thể cách mạng hóa phương pháp điều trị [rắn cắn]"
Joseph Jardine - phó giáo sư ngành miễn dịch học và vi sinh tại Viện Nghiên cứu Scripps cho rằng “Đây là một công trình nghiên cứu tuyệt vời”. Dù không trực tiếp tham gia vào nghiên cứu này nhưng trước đây ông từng công bố nhiều công trình về phát triển kháng độc tổng hợp cho các hợp chất tương tự. Ông cho rằng nghiên cứu mới không chỉ chứng minh những bước tiến vượt bậc trong công nghệ sản xuất protein nhờ vào sự phát triển mạnh mẽ của AI mà còn mở ra nhiều triển vọng đầy hứa hẹn cho ngành y học.
Mặc dù rắn cắn gây ra nhiều hậu quả nghiêm trọng, nhưng phương pháp điều trị nhiễm độc vẫn không thay đổi trong hơn một thế kỷ qua: Bằng cách sử dụng kháng thể thu thập từ ngựa hoặc các loài động vật khác sau khi chúng được tiêm một lượng nọc độc dưới ngưỡng gây chết. Dù có thể cứu sống nhiều người, các loại huyết thanh kháng nọc này vẫn tồn tại những hạn chế nhất định.

Trước hết, việc sản xuất huyết thanh kháng nọc rất tốn kém và phức tạp vì phải duy trì hệ thống chăn nuôi động vật. Chất lượng của chúng cũng không ổn định do hệ miễn dịch tự nhiên không hoàn hảo, dẫn đến hiệu quả điều trị không đồng đều.
Loại huyết thanh này thường có hiệu quả với một số độc tố nhất định, nhưng chỉ trung hòa được một phần nhỏ trong hỗn hợp phức tạp của nọc độc và kém hiệu quả hơn với vết cắn của một số loài rắn. Ngoài ra, chúng còn có thể gây kích ứng và dẫn đến các tác dụng phụ nguy hiểm cho người sử dụng.
Vì là sản phẩm sinh học, huyết thanh kháng nọc rất nhạy cảm với nhiệt độ, cần được bảo quản lạnh trong quá trình lưu trữ và vận chuyển, khiến chi phí tăng cao và hạn chế khả năng tiếp cận. Điều này đặc biệt gây khó khăn ở các vùng nông thôn tại các nước đang phát triển, nơi rắn cắn rất phổ biến nhưng việc điều trị lại vô cùng khó khăn.

Trái ngược với phương pháp điều trị truyền thống, các protein mới sở hữu nhiều ưu điểm vượt trội. Chúng có độ ổn định nhiệt cao hơn, cho phép bảo quản và vận chuyển dễ dàng hơn. Không những thế, chúng còn có thể được sản xuất hàng loạt bằng vi sinh vật như nấm men, giúp giảm chi phí sản xuất. Đặc biệt, các protein mới ít gây tác dụng phụ và có thể được điều chỉnh linh hoạt để đảm bảo tính nhất quán trong quá trình điều trị.
Jardine nhấn mạnh: "Những protein de novo nhỏ bé này mang lại nhiều lợi ích đáng kể, bao gồm khả năng chịu nhiệt, chi phí sản xuất thấp và khả năng định hướng chính xác mà kháng thể thông thường không thể đạt được." Ông cũng bày tỏ hy vọng rằng trong tương lai, sản phẩm này có thể được phát triển dưới dạng một thiết bị tương tự như bút tiêm EpiPen, cho phép nạn nhân tự tiêm protein một cách nhanh chóng ngay sau khi bị rắn cắn."
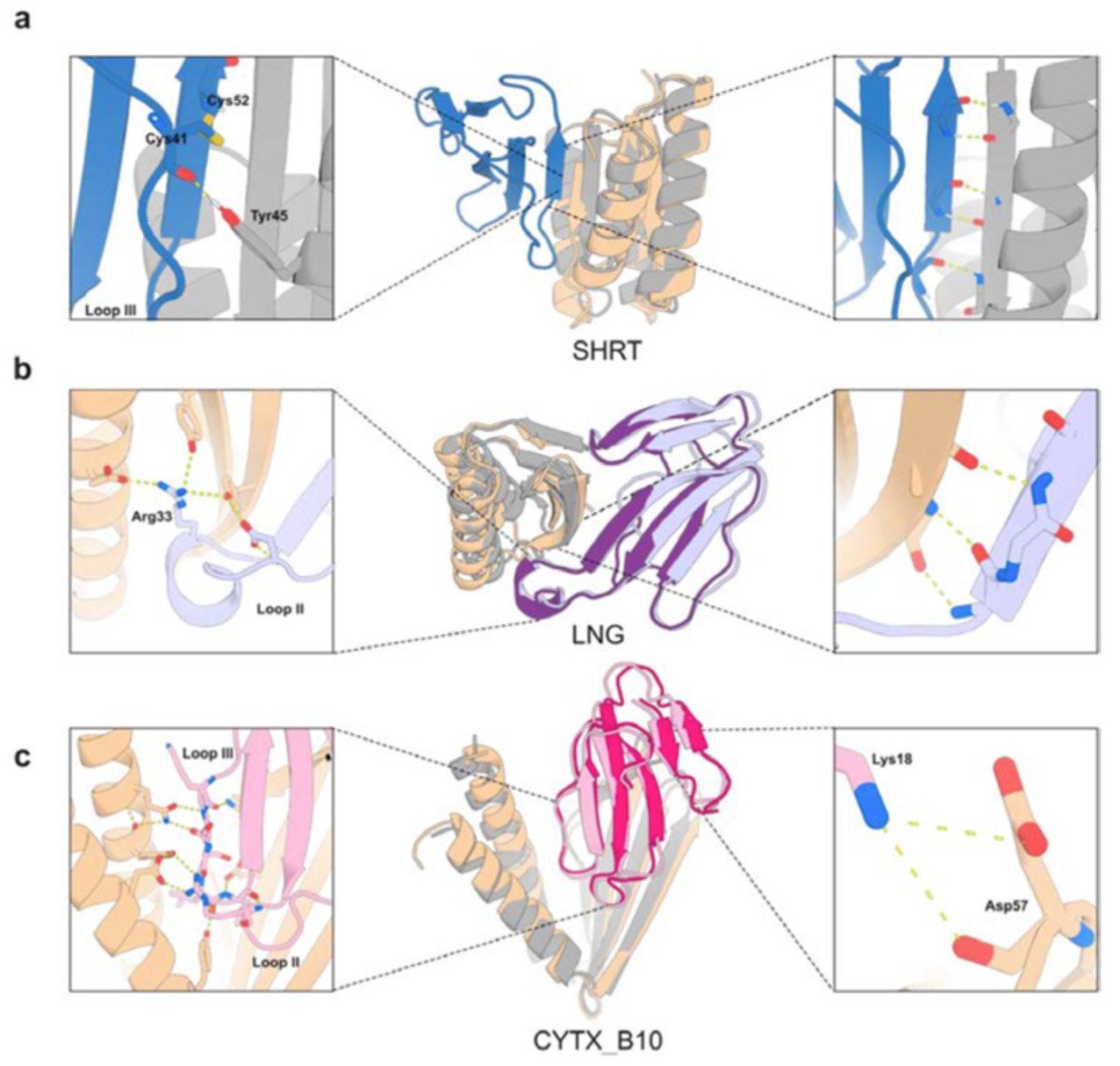
Nọc rắn là một hỗn hợp phức tạp chứa nhiều loại độc tố khác nhau. Vázquez Torres và cộng sự đặc biệt nghiên cứu nhóm độc tố ba ngón (3FTx) – hợp chất cực kỳ nguy hiểm mà huyết thanh kháng nọc truyền thống thường không thể vô hiệu hóa nó một cách triệt để.
3FTx đặc biệt phổ biến trong nọc của rắn thuộc họ Elapidae, bao gồm rắn hổ mang, rắn mamba và rắn san hô. Những độc tố này, vốn là các protein, có tác động tàn phá lên cơ thể động vật có vú: một số gây tê liệt thần kinh, trong khi số khác phá hủy tế bào và làm tổn thương mô nghiêm trọng.
Các nhà khoa học đặt mục tiêu xác định các protein giải độc để vô hiệu hóa ba loại độc tố đại diện: độc tố thần kinh alpha chuỗi ngắn, độc tố thần kinh alpha chuỗi dài và độc tố gây tổn thương tế bào. Cả ba loại độc tố này đều đã được nghiên cứu kỹ lưỡng, vì vậy các nhà khoa học đã biết rõ cấu trúc phức tạp của chúng ngay từ đầu. Dựa trên nền tảng đó, họ có thể xác định các vị trí liên kết quan trọng cần chặn để làm mất hoạt tính của từng loại độc tố.
Họ đưa thông tin này vào công cụ AI đầu tiên của mình là RoseTTAFold Diffusion – một mô hình tương tự như các trình tạo hình ảnh AI như DALL-E hay Midjourney, nhưng được đào tạo chuyên biệt để tạo ra các mô phỏng cấu trúc protein theo tiêu chí mong muốn.
Trong trường hợp này, tiêu chí đầu vào là cấu trúc của các độc tố và các “điểm nóng” liên kết mà nhóm nghiên cứu muốn vô hiệu hóa. AI đã đưa ra hàng chục gợi ý về các protein trung hòa (dưới dạng mô hình chi tiết của cấu trúc protein), có thể phù hợp với các vị trí liên kết này – tương tự như việc thiết kế chìa khóa để mở những ổ khóa chưa rõ cơ chế.
Để hiểu rõ hơn về các protein lý thuyết này và giải mã cấu trúc của chúng, Vázquez Torres, Baker cùng các đồng nghiệp đã sử dụng một mô hình AI tạo sinh thứ hai có tên ProteinMPNN. Mô hình này được huấn luyện để tạo ra các tổ hợp axit amin có thể gấp lại theo cấu trúc ổn định, từ đó tái tạo kết quả của mô hình khuếch tán.
Việc gấp protein là một quá trình phức tạp và khó dự đoán chỉ dựa trên trình tự axit amin, đồng thời cũng không dễ xác định chuỗi axit amin nào sẽ tạo ra hình dạng gấp cụ thể. ProteinMPNN giúp tăng tốc quá trình tính toán này.
Sau đó, nhóm nghiên cứu tiếp tục sử dụng AlphaFold2, một công cụ AI dự đoán, để kiểm tra xem mỗi chuỗi axit amin thực sự sẽ gấp lại như thế nào. Giữa mỗi bước, các chuyên gia đã sàng lọc những kết quả không khả thi và lựa chọn ra các ứng viên tiềm năng nhất.
Các tác giả nghiên cứu đã dịch ngược những chuỗi axit amin triển vọng nhất thành các trình tự DNA, sau đó sử dụng vi khuẩn đã được chỉnh sửa để tổng hợp các protein tương ứng. Họ thử nghiệm những ứng viên hàng đầu này trong các thí nghiệm trên đĩa petri với tế bào cơ và da người, và phát hiện ra rằng các protein này có hiệu quả chống lại cả ba loại độc tố mục tiêu. Quá trình sàng lọc tiếp tục thu hẹp phạm vi xuống còn một ứng viên tiềm năng nhất cho mỗi loại độc tố. Nhóm nghiên cứu sau đó đã thử nghiệm từng protein này trên chuột.
Trong các thí nghiệm ban đầu, ứng viên chống lại độc tố gây hoại tử không cho thấy hiệu quả trong việc giảm tổn thương da do nọc độc, nên nhóm nghiên cứu đã dừng thử nghiệm. Tuy nhiên, hai protein còn lại cho kết quả khả quan hơn. Khi được trộn trực tiếp với độc tố mục tiêu và tiêm vào chuột, cả hai protein kháng độc thần kinh đều giúp chuột sống sót hoàn toàn - trong khi ở nhóm không được bảo vệ bởi protein này, 100% chuột đều chết.
Để mô phỏng quá trình điều trị vết cắn thực tế, các nhà khoa học tiếp tục thử nghiệm bằng cách tiêm độc tố vào chuột trước, sau đó mới sử dụng protein kháng độc. Kết quả cho thấy một trong hai protein đã cứu sống toàn bộ số chuột ngay cả khi được tiêm muộn tới 30 phút sau khi bị nhiễm độc. Protein thứ hai có tỷ lệ cứu sống 80% nếu được tiêm sau 15 phút và 60% nếu tiêm sau 30 phút.
"Thật đáng kinh ngạc khi những protein này hoạt động ngay trên động vật mà không cần tinh chỉnh gì thêm," Vázquez Torres chia sẻ. "Việc tìm thấy một hợp chất hiệu quả ngay từ lần thử nghiệm đầu tiên là điều hiếm có." Hơn nữa, toàn bộ quá trình nghiên cứu, từ ý tưởng đến khi dữ liệu được gửi để xuất bản, chỉ mất khoảng một năm - nhờ sự hỗ trợ của AI trong tính toán. "Tôi nghĩ đây có thể là kỷ lục về tốc độ trong lĩnh vực nghiên cứu khoa học," cô nói, nhấn mạnh AI đã đẩy nhanh quá trình nghiên cứu đến mức nào.
Những phát hiện này chỉ là một phần của làn sóng tiến bộ mới trong nghiên cứu huyết thanh kháng nọc độc gần đây, bên cạnh các kháng thể tổng hợp của Jardine hay việc tái sử dụng các loại dược phẩm sẵn có. Tổ chức Y tế Thế giới (WHO) đã xếp nọc độc rắn vào danh sách Bệnh Nhiệt đới Bị Lãng quên (Neglected Tropical Disease) vào năm 2017 và đưa vấn đề này vào diện ưu tiên đầu tư và quan tâm hơn trong y tế cộng đồng.
Kể từ đó, nhiều nghiên cứu liên tục được công bố. Jardine nhận định “Phát hiện này bổ sung thêm một công cụ mới vào kho vũ khí của chúng ta trong cuộc chiến chống lại nọc độc rắn. Những protein này có ứng dụng riêng biệt mà kháng thể không thể thay thế, và ngược lại,”.
Tuy nhiên, vẫn còn cả một chặng đường dài trước khi những protein nhân tạo này có thể được phê duyệt cho con người. Các thử nghiệm trên chuột không cho thấy tác dụng phụ rõ ràng, nhưng vẫn chưa thể xác định chính xác cách các protein này hoạt động trong cơ thể và mức độ an toàn thực sự của chúng. Vì đây là những phân tử hoàn toàn mới, chúng cần trải qua nhiều vòng kiểm tra nghiêm ngặt để đánh giá khả năng phản ứng ngoài mục tiêu và các tác động không mong muốn.
Theo lời của cả Vázquez Torres và Jardine. “Chúng ta cần chứng minh các phân tử này an toàn. Chúng ta cần hiểu rõ cơ chế hoạt động của chúng,” Vázquez Torres nhấn mạnh. Sẽ còn mất nhiều năm nữa trước khi một loại huyết thanh kháng nọc độc từ protein thiết kế có thể ra thị trường.
Ngay cả khi điều đó trở thành hiện thực, những protein mà Vázquez Torres và cộng sự tìm ra vẫn chưa đủ. Chúng chỉ có tác dụng với hai loại độc tố riêng lẻ trong một số loại nọc rắn nhất định. Theo Vázquez Torres, có thể cần đến khoảng mười loại protein được thiết kế đặc biệt để trung hòa hoàn toàn một loại nọc độc. Cuộc tìm kiếm một loại huyết thanh phổ rộng hay thậm chí là một loại huyết thanh kháng nọc độc toàn cầu vẫn đang tiếp tục.
Mặc dù còn nhiều vấn đề nan giải nhưng triển vọng sử dụng vi sinh vật để tạo ra các loại protein theo yêu cầu đang khiến giới khoa học háo hức, và ứng dụng này không chỉ dừng lại ở việc sản xuất huyết thanh kháng nọc độc.
Trong tương lai, protein nhân tạo có thể mở ra những phương pháp điều trị thay thế cho nhiều loại bệnh khác. Các chuỗi axit amin này nằm ở ranh giới giữa thuốc sinh học (được tạo ra hoặc chiết xuất từ sinh vật sống) và thuốc phân tử nhỏ như aspirin (được tổng hợp hóa học). “Chúng ta có thể hình dung vô số vấn đề mà phương pháp này có thể giải quyết - những vấn đề mà các cách tiếp cận truyền thống không thể làm được,” Jardine nói. “Đây là một hướng đi hoàn toàn mới và chúng ta mới chỉ chạm đến bề nổi.”